Esporotricose
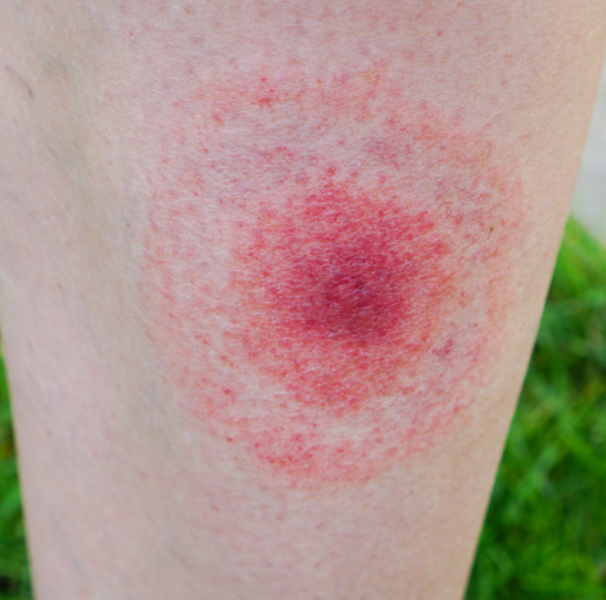
Esporotricose A esporotricose é uma micose subcutânea causada por fungos do gênero Sporothrix, sendo Sporothrix schenckii a espécie mais comumente associada a infecções em humanos. A doença é considerada uma zoonose emergente e tem ganhado relevância na saúde pública devido ao aumento do número de casos, especialmente em áreas urbanas, onde a transmissão está frequentemente associada a gatos domésticos infectados. O fungo está amplamente distribuído no ambiente, sendo encontrado no solo, vegetais, palha, madeira em decomposição e materiais orgânicos contaminados. A infecção ocorre principalmente por inoculação traumática, quando o fungo penetra a pele através de arranhaduras, mordidas de animais ou contato com materiais contaminados. Além disso, há relatos de transmissão respiratória, levando a formas pulmonares da doença, embora essa via seja menos comum. A esporotricose pode se manifestar de diferentes formas clínicas, desde lesões cutâneas localizadas até formas disseminadas, que acometem órgãos internos e representam risco de complicações graves, especialmente em pacientes imunossuprimidos. Devido à sua importância crescente, o reconhecimento precoce da infecção e o tratamento adequado são essenciais para o controle da doença e a prevenção de surtos. Agente Etiológico Sporothrix schenckii Um fungo dimórfico que pode existir na forma de levedura ou hifa, dependendo das condições ambientais. Esse patógeno é encontrado amplamente no solo, em plantas e em materiais orgânicos em decomposição. Ele pode infectar tanto seres humanos quanto animais, especialmente gatos, que são considerados os principais vetores urbanos da doença. Epidemiologia A esporotricose é uma micose subcutânea causada por fungos do gênero Sporothrix, destacando-se como uma zoonose emergente no Brasil. Historicamente, a doença estava associada a áreas rurais, afetando indivíduos em contato com solo e vegetação em decomposição. No entanto, a partir da década de 1990, observou-se uma mudança significativa no perfil epidemiológico, com um aumento expressivo de casos em áreas urbanas, especialmente relacionados à transmissão zoonótica por gatos domésticos infectados. Surto no Rio de Janeiro O estado do Rio de Janeiro foi palco de um dos maiores surtos de esporotricose zoonótica. A partir da década de 1990, houve uma explosão de casos em felinos, que atuaram como principais transmissores da doença para humanos. Estima-se que, até 2019, todos os estados brasileiros, exceto Roraima, já haviam registrado casos de esporotricose humana, refletindo a disseminação da doença pelo país. Dados Recentes De acordo com o Ministério da Saúde, em 2023 foram atendidos 1.239 casos de esporotricose em humanos no Brasil. Até junho de 2024, outros 945 casos já haviam sido registrados, indicando uma tendência de aumento na incidência da doença. Principais Reservatórios A esporotricose tem como principais reservatórios o meio ambiente e os animais infectados, sendo os gatos domésticos a principal fonte de transmissão zoonótica para humanos. No ambiente natural, o fungo Sporothrix spp. vive como saprófita no solo, em matéria orgânica em decomposição, madeira, plantas espinhosas, feno e serragem. O contato com esses materiais contaminados pode levar à infecção, principalmente através de ferimentos na pele. Os gatos, no entanto, representam o reservatório mais importante em áreas urbanas, pois além de serem altamente suscetíveis à doença, desenvolvem lesões ulceradas com grande carga fúngica, tornando a transmissão mais eficaz. A infecção em humanos ocorre principalmente por arranhaduras, mordidas ou contato direto com secreções das lesões contaminadas. Diferente de outros animais, os gatos eliminam o fungo em grande quantidade, favorecendo surtos e tornando a esporotricose uma preocupação crescente na saúde pública. Outros animais também podem atuar como reservatórios, embora com menor relevância. Cães podem ser acometidos, mas os casos são raros. Roedores, como ratos, podem carregar o fungo e contaminar o ambiente, enquanto cavalos, bovinos e algumas espécies silvestres também já foram relatados como hospedeiros ocasionais da infecção. No entanto, nenhum desses animais desempenha um papel tão significativo quanto os gatos na disseminação da doença. A presença desses reservatórios, especialmente os felinos infectados, reforça a necessidade de medidas de controle populacional, diagnóstico precoce e tratamento adequado para evitar a propagação da esporotricose, principalmente em centros urbanos onde a convivência com gatos é intensa. Quadro Clínico A esporotricose pode se manifestar de diferentes formas clínicas, dependendo da via de infecção, da imunidade do paciente e da extensão da disseminação do fungo no organismo. A apresentação mais comum é a forma cutânea, mas casos sistêmicos podem ocorrer, especialmente em indivíduos imunocomprometidos. Forma Cutânea (Mais comum) A esporotricose cutânea ocorre quando o fungo Sporothrix spp. penetra na pele através de ferimentos ou arranhaduras, frequentemente associada ao contato com gatos infectados ou material vegetal contaminado. Inicialmente, aparece um nódulo avermelhado e indolor, que pode ulcerar e drenar secreção purulenta. Em algumas semanas, novas lesões surgem ao longo do trajeto dos vasos linfáticos, formando um padrão característico chamado esporotricose cutâneo-linfática. Além dessa apresentação, há também a forma cutânea fixa, na qual a infecção se restringe a uma única lesão nodular ou ulcerada, sem disseminação linfática. Esse tipo é mais frequente em indivíduos com boa resposta imunológica. Forma Mucosa O fungo pode afetar mucosas, especialmente do nariz, boca e faringe, causando úlceras dolorosas e crônicas. Essa forma é menos comum, mas pode ocorrer em pessoas que inalam o fungo ou em casos de disseminação a partir de lesões cutâneas. Forma Pulmonar Embora rara, a esporotricose pulmonar pode ocorrer quando o fungo é inalado, principalmente em trabalhadores expostos a grandes quantidades de material contaminado, como agricultores e jardineiros. A infecção pode se manifestar como tosse persistente, febre, dor torácica e sintomas semelhantes à tuberculose, com formação de nódulos pulmonares ou cavitações. Forma Disseminada (Mais grave) A esporotricose disseminada é a forma mais grave da doença e ocorre quando o fungo se espalha pela corrente sanguínea, afetando órgãos internos como pulmões, fígado, ossos e até o sistema nervoso central. Esse quadro é mais comum em pacientes imunossuprimidos, como portadores de HIV/AIDS e pessoas em tratamento com imunossupressores. A doença pode levar a febre persistente, lesões cutâneas múltiplas, comprometimento ósseo e até meningite fúngica, tornando-se uma infecção potencialmente fatal se não tratada. A esporotricose é uma micose subcutânea causada por fungos do gênero Sporothrix, destacando-se como uma zoonose emergente no Brasil. Historicamente, a doença estava associada a áreas