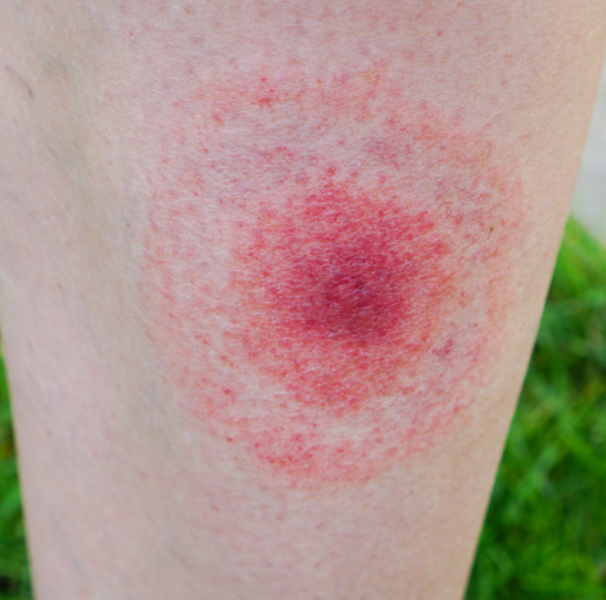
Tularemia A tularemia é uma zoonose infecciosa aguda, potencialmente grave, causada pela bactéria Francisella tularensis. Trata-se de uma doença rara, mas de importância epidemiológica significativa devido ao seu potencial de uso como agente de bioterrorismo, alta infectividade (bastam poucos microrganismos para causar doença) e grande diversidade de manifestações clínicas. O ser humano é considerado um hospedeiro acidental e adquire a infecção principalmente por contato com animais silvestres, vetores artrópodes ou pela ingestão de água ou alimentos contaminados. Agente Etiológico Francisella tularensis O agente da tularemia é a Francisella tularensis, uma bactéria Gram-negativa, cocobacilar, aeróbica e intracelular facultativa. Existem quatro subespécies principais: F. tularensis tularensis (Tipo A) – mais virulenta, predominante na América do Norte; F. tularensis holarctica (Tipo B) – menos virulenta, comum na Europa e Ásia; F. tularensis mediasiatica – rara, restrita à Ásia Central; F. tularensis novicida – causa infecção mais branda, raramente patogênica para humanos. A subespécie tularensis (Tipo A) está associada aos quadros mais graves, enquanto a holarctica tende a causar formas mais brandas da doença. Epidemiologia A tularemia ocorre no hemisfério norte, especialmente em países da América do Norte, Europa e partes da Ásia. Nos Estados Unidos, é doença de notificação obrigatória, com maior incidência nos estados do centro-sul. No Brasil, não há casos humanos confirmados, mas a bactéria já foi isolada em ambientes silvestres da região Norte, e a doença é considerada de potencial emergente em áreas tropicais com amplos vetores e reservatórios naturais. Incidência: Rara (EUA: 100–200 casos por ano), mas pode ocorrer em surtos locais. Mortalidade: Varia de 1% nas formas tratadas até 30% nas formas pneumônicas não tratadas. Morbidade: Alta em formas ulceroglandulares, com febre, mal-estar e linfadenopatia prolongada. Perfil do paciente típico: Trabalhadores rurais, caçadores, manipuladores de animais silvestres, pessoas expostas a carrapatos ou mosquitos em regiões endêmicas. Principais Reservatórios A bactéria está amplamente distribuída na natureza e infecta mais de 200 espécies de animais. Os principais reservatórios incluem: Roedores silvestres (lebres, esquilos, ratos), Coelhos (especialmente nos EUA), Aves aquáticas, Carrapatos e mosquitos, que atuam como vetores e reservatórios secundários. A transmissão ao ser humano pode ocorrer por: Mordidas ou arranhaduras de animais silvestres, Picadas de carrapatos, mosquitos ou moscas, Inalação de poeira contaminada (feno, grãos), Ingestão de água ou alimentos contaminados, Contato direto com tecidos ou fluidos de animais infectados. Ciclo de Vida A Francisella tularensis é mantida na natureza em ciclos zoonóticos envolvendo roedores e artrópodes vetores, como carrapatos. Após o contato com o hospedeiro acidental (humano), a bactéria penetra pela pele, mucosas ou trato respiratório e se replica nos macrófagos, disseminando-se para linfonodos, fígado, baço e pulmões. Por ser intracelular, escapa da imunidade inata e induz inflamação intensa nos tecidos acometidos. Quadro Clínico A apresentação clínica da tularemia depende da via de infecção, podendo se manifestar como formas localizadas (ulceroglandular, glandular, ocular) ou sistêmicas (orofaríngea, pneumônica e tifoidal). A forma ulceroglandular é a mais comum. A infecção geralmente se inicia com febre súbita, calafrios, cefaleia e mal-estar. Tularemia ulceroglandular Mais comum (75% dos casos)Essa forma resulta da inoculação direta da bactéria na pele por mordidas de animais ou picadas de vetores (como carrapatos e mosquitos), ou ainda pela manipulação de animais doentes. Após um período de incubação de 3 a 5 dias, surge uma pápula eritematosa no local da inoculação, que rapidamente evolui para uma úlcera necrótica com bordas elevadas e fundo esfacelado. A linfadenopatia regional é intensa, dolorosa, podendo supurar. Sinais e sintomas: Lesão cutânea ulcerada (com crosta ou secreção) Linfonodos regionais aumentados, endurecidos e dolorosos Febre alta de início súbito Calafrios, sudorese, mal-estar geral Tularemia glandular Sem úlcera cutânea visívelSemelhante à forma ulceroglandular, porém sem a lesão primária de pele. A bactéria provavelmente penetra através de abrasões cutâneas muito pequenas ou vias mucosas e se aloja nos linfonodos regionais. Pode ser confundida com adenite bacteriana comum. Sinais e sintomas: Linfadenomegalia dolorosa, com ou sem sinais flogísticos Febre alta e calafrios Sudorese, fadiga e mialgia Tularemia oculoglandular Infecção da conjuntivaOcorre quando a bactéria é inoculada nos olhos, geralmente por mãos contaminadas ou aerossóis. A conjuntiva é invadida e ocorre inflamação intensa com linfadenite pré-auricular. Pode simular conjuntivite bacteriana comum, mas com evolução mais agressiva. Sinais e sintomas: Conjuntivite unilateral intensa, com hiperemia e secreção Dor ocular e sensação de corpo estranho Linfadenopatia pré-auricular Edema palpebral e fotofobia Tularemia orofaríngea Transmissão por ingestão de água ou alimentos contaminadosÉ mais comum em surtos, sobretudo em áreas rurais com acesso a água não tratada. A infecção se instala na mucosa orofaríngea, gerando lesões ulceradas ou pseudomembranosas, semelhante a angina infecciosa. Os linfonodos cervicais são frequentemente acometidos. Sinais e sintomas: Faringite intensa com exsudato ou ulceração Dor ao engolir (odinofagia) Febre alta Linfadenopatia cervical dolorosa Náuseas e dor abdominal (em casos mais graves) Tularemia pneumônica Forma mais grave e potencialmente fatalOcorre pela inalação de aerossóis contaminados (ex. feno, grãos ou poeira com excretas de roedores), sendo considerada forma primária. Também pode surgir como complicação de outra forma clínica (disseminação hematogênica). Apresenta alto risco de sepse e mortalidade elevada sem tratamento precoce. Sinais e sintomas: Tosse seca ou produtiva, às vezes com expectoração hemoptoica Dispneia e dor torácica pleurítica Febre alta e calafrios intensos Taquipneia, taquicardia e hipoxemia Infiltrado pulmonar localizado ou bilateral na radiografia/TC Tularemia tifoide Forma sistêmica sem foco aparenteÉ a forma mais rara e grave, resultando de disseminação hematogênica sem lesões visíveis iniciais. Comumente ocorre em pacientes imunossuprimidos. Apresenta risco elevado de choque séptico, coagulação intravascular disseminada (CIVD) e falência múltipla de órgãos. Sinais e sintomas: Febre alta contínua e refratária Prostração intensa Náuseas, vômitos, perda de peso Hepatoesplenomegalia Hipotensão, choque séptico Potencial envolvimento de fígado, baço, pulmões, rins e cérebro Mais comum (75% dos casos)Essa forma resulta da inoculação direta da bactéria na pele por mordidas de animais ou picadas de vetores (como carrapatos e mosquitos), ou ainda pela manipulação de animais doentes. Após um período de incubação de 3 a 5 dias, surge uma pápula eritematosa no local da inoculação, que rapidamente evolui para uma úlcera necrótica com bordas elevadas e fundo esfacelado. A linfadenopatia