Herpes Zóster
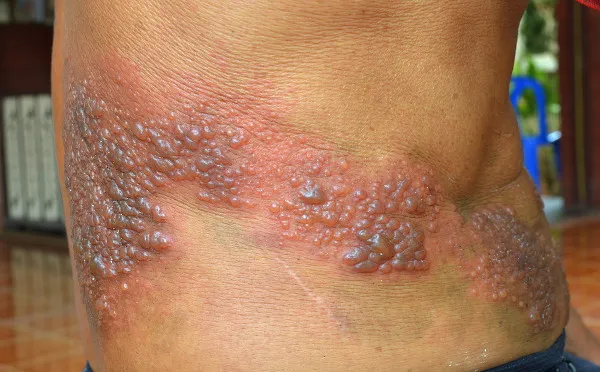
Herpes Zóster Herpes zóster, conhecido popularmente como “cobreiro,” é uma infecção viral causada pela reativação do vírus varicela-zóster, o mesmo responsável pela catapora. Após a infecção inicial, geralmente na infância, o vírus permanece dormente no sistema nervoso e pode se reativar anos ou décadas depois, causando dor intensa e erupções cutâneas. Essa condição, embora comum, é frequentemente subestimada em termos de impacto na qualidade de vida dos pacientes. O entendimento profundo das causas, dos fatores de risco e das opções de tratamento é essencial para a gestão eficaz do herpes zóster, especialmente em populações envelhecidas ou imunocomprometidas. Fisiopatologia A fisiopatologia do herpes zóster envolve a reativação do vírus varicela-zóster (VVZ), que é o mesmo vírus responsável pela catapora. Após a infecção inicial, o vírus permanece dormente nos gânglios nervosos. Com o avanço da idade ou em momentos de enfraquecimento do sistema imunológico, o vírus pode se reativar e viajar ao longo das fibras nervosas até a pele, causando a erupção característica e a dor intensa. A dor inicial é geralmente localizada e pode ser acompanhada de prurido, formando vesículas que se rompem e formam crostas. Em alguns casos, a dor pode persistir após a cicatrização das lesões cutâneas, uma condição conhecida como neuralgia pós-herpética. Principais Causas A herpes zóster é causada pela reativação do vírus varicela-zóster (VVZ), que é o mesmo vírus responsável pela catapora. Algumas das principais causas que podem desencadear essa reativação incluem: Envelhecimento do sistema imunológico: À medida que envelhecemos, nosso sistema imunológico tende a enfraquecer, o que pode permitir que o vírus se reative. Imunocomprometimento: Condições que enfraquecem o sistema imunológico, como doenças autoimunes, HIV/AIDS, ou o uso de medicamentos imunossupressores, aumentam o risco de reativação do vírus. Estresse: Situações de estresse físico ou emocional podem enfraquecer temporariamente o sistema imunológico, facilitando a reativação do vírus. Doenças crônicas: Condições crônicas como diabetes ou doenças pulmonares podem comprometer o sistema imunológico e aumentar o risco de herpes zóster. Descrição Dermatológica Agora vamos criar um exemplo fictício de uma descrição semiológica dessa lesão de pele: “Paciente apresenta lesões vesiculares agrupadas em região torácica direita, seguindo a distribuição do nervo intercostal. As vesículas são pequenas, cheias de líquido claro, e estão dispostas sobre base eritematosa. Há presença de dor intensa na área afetada, relatada pelo paciente como ardente e pulsátil. Algumas vesículas já se romperam, formando crostas. Não há sinais de infecção secundária aparente. Sensibilidade local aumentada ao toque.” Tratamento O tratamento para herpes zóster geralmente envolve o uso de antivirais e analgésicos. Aqui estão algumas opções comuns: Antivirais: Medicamentos como aciclovir, valaciclovir e famciclovir são frequentemente prescritos para reduzir a duração e a gravidade da infecção. Eles são mais eficazes quando iniciados nas primeiras 72 horas após o aparecimento das vesículas. Analgésicos: Para aliviar a dor, podem ser utilizados analgésicos como paracetamol ou ibuprofeno. Em casos mais graves, analgésicos mais potentes podem ser necessários. Antihistamínicos: Para controlar o prurido (coceira) associado às vesículas, antihistamínicos podem ser prescritos. Cuidados com a pele: Manter a área afetada limpa e seca pode ajudar a prevenir infecções secundárias. Cortar as unhas das mãos e evitar coçar as vesículas também são recomendações importantes. Em casos de herpes zóster com risco de complicações, como em pessoas imunocomprometidas, o tratamento pode incluir a administração de antivirais por via intravenosa. A herpes zóster é causada pela reativação do vírus varicela-zóster (VVZ), que é o mesmo vírus responsável pela catapora. Algumas das principais causas que podem desencadear essa reativação incluem: Envelhecimento do sistema imunológico: À medida que envelhecemos, nosso sistema imunológico tende a enfraquecer, o que pode permitir que o vírus se reative. Imunocomprometimento: Condições que enfraquecem o sistema imunológico, como doenças autoimunes, HIV/AIDS, ou o uso de medicamentos imunossupressores, aumentam o risco de reativação do vírus. Estresse: Situações de estresse físico ou emocional podem enfraquecer temporariamente o sistema imunológico, facilitando a reativação do vírus. Doenças crônicas: Condições crônicas como diabetes ou doenças pulmonares podem comprometer o sistema imunológico e aumentar o risco de herpes zóster. Agora vamos criar um exemplo fictício de uma descrição semiológica dessa lesão de pele: “Paciente apresenta lesões vesiculares agrupadas em região torácica direita, seguindo a distribuição do nervo intercostal. As vesículas são pequenas, cheias de líquido claro, e estão dispostas sobre base eritematosa. Há presença de dor intensa na área afetada, relatada pelo paciente como ardente e pulsátil. Algumas vesículas já se romperam, formando crostas. Não há sinais de infecção secundária aparente. Sensibilidade local aumentada ao toque.” O tratamento para herpes zóster geralmente envolve o uso de antivirais e analgésicos. Aqui estão algumas opções comuns: Antivirais: Medicamentos como aciclovir, valaciclovir e famciclovir são frequentemente prescritos para reduzir a duração e a gravidade da infecção. Eles são mais eficazes quando iniciados nas primeiras 72 horas após o aparecimento das vesículas. Analgésicos: Para aliviar a dor, podem ser utilizados analgésicos como paracetamol ou ibuprofeno. Em casos mais graves, analgésicos mais potentes podem ser necessários. Antihistamínicos: Para controlar o prurido (coceira) associado às vesículas, antihistamínicos podem ser prescritos. Cuidados com a pele: Manter a área afetada limpa e seca pode ajudar a prevenir infecções secundárias. Cortar as unhas das mãos e evitar coçar as vesículas também são recomendações importantes. Em casos de herpes zóster com risco de complicações, como em pessoas imunocomprometidas, o tratamento pode incluir a administração de antivirais por via intravenosa. As lesões do herpes zóster geralmente aparecem como uma faixa ou agrupamento de vesículas (bolhas cheias de líquido) sobre uma base eritematosa (vermelha). Essas vesículas tendem a seguir a distribuição de um nervo específico, respeitando a linha média do corpo. Com o tempo, as vesículas rompem, formando crostas que eventualmente caem. A área afetada pode ser extremamente dolorosa e sensível ao toque. 📚 Referências Bibliográficas Patil A, Goldust M, Wollina U. Herpes zoster: A Review of Clinical Manifestations and Management. Patil A, Goldust M, Wollina U. Viruses. 2022;14(2):192. Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Articulação Estratégica de Vigilância em Saúde. Guia de Vigilância em Saúde [recurso eletrônico] / Ministério da Saúde, Secretaria de Vigilância em